אלה שיהנו במיוחד מתכשיר מעכב הזדקנות הם אלה שטרם הזדקנו. אנשים, כל אחד לפי גילו, לא מאחלים לעצמם זקנה ארוכה. בני 20 מאחלים למות בגיל 60, "לפני שהם יהיו זקנים". בני 30 בגיל 70, ובני 40 בגיל 80. סבתי בת 91 אמרה לי רק לפני כמה ימים שהיא "תשמח לעוד כמה שנים". ככל הנראה זו שאלה של פרספקטיבה. בהנתן הלך הרוח הזה אפשר להבין למה אנשים צעירים לא מוצאים הבטחה גדולה בתכשירים מעכבי הזדקנות, שבהערכה אופטימית יגיעו רק בעוד עשרות שנים כאשר הם כבר זקנים מכדי להנות מהם, לתפיסתם. כאמור, אפשר לפקפק בתפיסה זו כי רוב הזקנים לא מבקשים למות, אבל ברור שהערך של תכשיר שלא רק מעכב או עוצר את ההזדקנות אלא מסיג אותה לאחור הוא גדול לאין ערוך. מבחינה טכנולוגית זה נשמע הרבה יותר שאפתני. מילא משהו שגורם לך להזדקן לאט יותר, הרי צבים עושים את זה, אבל ללכת לישון זקן ולהתעורר צעיר? זה כבר נשמע ממש כמו מדע בדיוני. האם יש תימוכין להיתכנות של דבר כזה?
בפוסט קודם עסקתי בשאלה אם באופן עקרוני אפשר להסיג לאחור את ההזדקנות, בהנתן שמדובר בהצטברות של נזק מולקולרי, ועניתי עליה בחיוב. אבל עכשיו אני שואל האם זה מעשי. מעשי – תכשיר רפואי שמבוסס על כמה מולקולות; לא מעשי – ננובוטים שמתרוצצים בגוף שלנו ומתקנים כל תא בעזרת ננו-פטיש וננו-מסמר. ובכן, מסתבר שלאופציה המעשית יש היתכנות. כמה וכמה מחקרים בתרביות תאים ובעכברים הראו שזקנה, או לפחות אספקטים מסויימים שלה, היא עניין פלסטי. כלומר, הם לא הסתפקו בלהאריך את משך החיים של העכבר, דבר שיכול להעיד על עיכוב תהליך ההזדקנות, אלא הם לקחו עכבר זקן או תא זקן והראו שהטיפול עושה אותו צעיר יותר, מבחינות מסויימות. להלן ליקטתי את הדוגמאות הכי משכנעות.
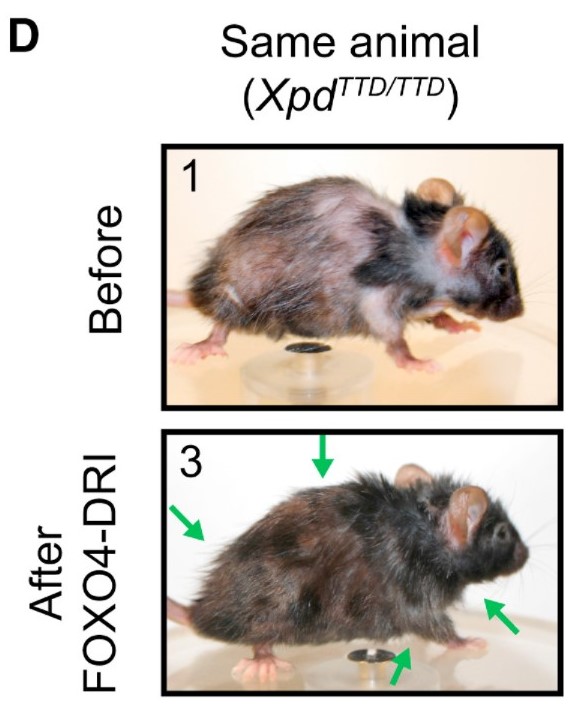
קבוצת חוקרים מאוניברסיטת ארסמוס ברוטרדם השיגו תוצאות ממש מרשימות באמצעות סוג של סנותרפיה, היינו סילוק של תאים סנסנטיים [1]. מי שרוצה להבין בדיוק במה מדובר מוזמן לקרוא את הפוסט על סנותרפיה. בקצרה, תאים סנסנטיים הם תאים שחלוקתם נעצרה כתגובה לנזק. עם הגיל, תאים כאלה מצטברים ומביאים לירידה בתפקוד הרקמות, ולמעשה להזדקנות. החוקרים מצאו דרך להשרות אפופטוזה (מוות תאי מתוכנת) בתאים סנסנטיים באמצעות פפטיד (פפטיד הוא חלבון קצר. כשאתה רוצה לחדור לתא עוזר להיות קצר) שמפריע לאינטראקציה של שני גנים חשובים בתאים סנסנטיים – FOXO4 ו-p53. התוצאה היתה רסטורציה של צפיפות שיער, תפקות כליות ועוד כמה דברים נחמדים:
דוגמא נוספת: דנא מיטוכונדריאלי (דנא שנמצא במיטוכונדריה, האברון בתא בו מופקת אנרגיה), להבדיל מדנא גרעיני (דנא שנמצא בגרעין התא), מהווה חלק קטן מכלל הדנא בתא. במהלך ההזדקנות חלה ירידה טבעית בכמות הדנא המיטוכונדריאלי. חוקרים מאוניברסיטת אלבמה שבבירמינגהם הנדסו גנטית עכבר (זו פרקטיקה סטנדרטית במחקר ביולוגי, לא איזה מעשה פרנקנשטיין) שאפשר להשרות בו הרקה (כלומר הוצאת תוכן) של הדנא המיטוכונדריאלי בכל התאים בגוף. הרקה זו במשך חודשיים הובילה לפנוטיפ דמוי-זקנה (פרוגרואידי), שכלל בין השאר נשירת שיער והתקמטות של העור [2]. למרבה הפלא, לאחר חודש אחד של נרמול רמות הדנא המיטוכונדריאלי (ע"י הפסקת השראת ההרקה) העור והשיער השתקמו, באופן שניכר בעין בלתי מזויינת וגם מתחת למיקרוסקופ (מספר זקיקי השיער עלה וסימני הדלקתיות פחתו):

אוטופאגיה (אוטו = עצמי, פאגיה = אכילה) הוא המנגנון הטבעי שגורם להרס ופירוק של מרכיבים תאיים לא מתפקדים או לא נחוצים. אוטופאגיה מהווה חלק חשוב מתהליך חילוף החומרים ובקרת האיכות של התא. בהזדקנות חלה ירידה באוטופאגיה. חוקרים מקיימברידג' הראו בעזרת מודל עכברי גנטי שדיכוי אוטופאגיה משרה סימפטומים של הזדקנות [3]. בעכברים שהם הנדסו אפשר לכבות את הביטוי של הגן Atg5 ששולט בתהליך האוטופאגיה בעזרת doxycycline (או dox בקיצור. זו סוג של אנטיביוטיקה, שמשמשת כאן כרגולטור ללא קשר לסגולות האנטיביוטיות שלה). דיכוי האוטופאגיה למשך 4 חודשים גרר שינויים פיזיים גלויים כמו גבנון והאפרת שיער, והמשך הדיכוי קיצר את תוחלת החיים:

כדי לראות אם מדובר באפקט הפיך החוקרים גמלו קבוצה של עכברים מה-dox ואפשרו לאוטופאגיה לחזור לרמות המקוריות שלה. לאחר 4 חודשים של גמילה חלה נסיגה חלקית של סממני ההזדקנות, כפי שבא לידי ביטוי באינדקס השבריריות (Frailty):

אינדקס השבריריות הוא מדד שמשקלל את אוסף של פנוטיפים של הזדקנות, ביניהם אובדן שיער, אובדן צבע שיער, אובדן שפם, ירידה באיכות פרווה, נוכחות גידולים, גבנון, כוח אחיזה, אובדן ראיה ועוד. בנוסף תוחלת החיים כמעט התנרמלה:

החוקרים הדגישו שההסגה לאחור של סממני ההזדקנות בעקבות הגמילה היתה חלקית בלבד. למשל, הצבע לא חזר לשיער והגבנון השתקם בצורה חלקית ביותר (לא סופקו תמונות).
אולי טיפול ההצערה המבטיח ביותר מבוסס על מה שנקרא cellular reprogramming או induced pluripotency. הנושא הזה ראוי לפוסט משל עצמו, ולכן בפוסט הזה רק אסביר את העקרון ואציין את התוצאות העיקריות. בקצרה, מדובר בטכניקה למחוק את השינויים האפיגנטיים שחלים בתאים במהלך ההתפתחות. כך נמחקת הזהות הנרכשות של תאים, היינו אם הם תאי עור או שריר, והם הופכים לתאי גזע פלוריפוטנטיים, שהם תאים בעלי פוטנציאל התמיינות לסוגי תא שונים (בניגוד לתאים בוגרים, שיכולים להתחלק לשני תאים זהים אבל לא להפוך לתא מסוג אחר). מספר מחקרים טענו שיחד עם התכונות האלה נמחקים גם סממני ההזדקנות של התאים [4]. כלומר, אם לוקחים תאי עור מנסיין זקן, מבצעים בהם reprogramming (להלן רפרוגרמינג) בתוך תרבית (במהלכה הם חוזרים להיות תאי גזע), ואז ממיינים אותם שוב לתאי עור (מיון = הקניית זהות לתא באמצעות גירויים ספציפיים), מתקבלים תאי עור צעירים. צעירים לפי איזה מדד? כמה מדדים חשובים ביניהם אורך הטלומרים (קצוות הכרומוזומים שנשחקים עם הגיל), תפקוד המיטוכונדריה, והגיל האפיגנטי, שנמדד בעזרת "השעון האפיגנטי" (עוד חוב שיש לי לבלוג. מדובר במדידה של סמנים אפיגנטיים שיכולה לחזות כמה זמן נשאר לנו לחיות יותר טוב מהגיל הכרונולוגי שלנו).
רוב המחקרים ברפרוגרמינג נעשו בתרביות תאים ולא על אורגניזם שלם, כיוון שהם התמקדו בתהליכים שחלים בתאים עצמם. כשהתהליך הזה מיושם בתוך גוף חי (מה שנקרא in vivo) התוצאה היא היווצרות של טרטומות, גידולים שמכילים תערובת של רקמות שונות (אפשר למצוא שם למשל שיער ושיניים. איכס), והתפתחות של סרטן [5]. ב-2016 הראו שעל ידי השראה מבוקרת (לסירוגין) של רפרוגרמינג אפשר להמנע מהיווצרות של טרטומות ולהאריך את משך החיים של עכברים פרוגרואידים [6]. בשנת 2020 קבוצת חוקרים מהמחלקה לגנטיקה בהרווארד הראו שרפרוגרמינג של תאי גנגליון, תאי עצב ברשתית העין, מקדם רגנרציה של עצב הראיה אחרי פציעה, וגם משיב את הראיה לעכברים עם גלאוקומה ועכברים זקנים [7].

כיום נעשים נסיונות להפריד את ההיבט של ההצערה מההיבט של מחיקת זהות התא על ידי השראה קצובה של רפרוגרמינג. רפרוגרמינג זה תהליך רב-שלבי. על ידי השראתה עד לשלב הבשלות (Maturation phase) בלבד, חוקרים הצליחו לגלח ~30 שנים מהגיל האפיגנטי של תאי סיב (תאים שיוצרים את סיבי הקולגן שמרכיבים את העור, משמשים כמודל בהרבה מחקרים) מתורמים אנושיים זקנים, תוך שמירה על הזהות של התא כתא סיב [8].

בשורה התחתונה, קיים גוף ראיות משמעותי שמראה שהזדקנות היא תהליך הפיך, לפחות חלקית, ולפחות בעכברים ובתרביות תאים. במאמר [9] של אן ברונט ושות' מסטנפורד נכללו יותר מ-50 מחקרים שמראים הסגה לאחור של אספקטים שונים של הזדקנות (אם כי ממעבר על המקורות שלהן לא השתכנעתי שכולם מראים הפיכות ולא רק עיכוב). יחד עם זאת, חסרות עדויות לכך שניתן להסיג לאחור שינויים מבניים משמעותיים כמו גיבנת. בנוסף אני בספק שטיפול שמסיג לאחור את ההזדקנות יוכל גם למחוק צלקות או לגרום לרגנרציה של איברים שנגדעו. מצד שני, תינוקות בני יומם יכולים להצמיח מחדש את קצות האצבעות שלהם אם קוטעים אותן (תנסו!), אז לכו תדעו. הפוטנציאל הכי גדול טמון לדעתי בפרדיגמת הרפרוגרמינג. לא מן הנמנע שהצערת התאים (ובמיוחד תאי גזע בוגרים שנמצאים בכמויות קטנות ברקמות שונות) לאורך זמן תוביל לשיקום מבני ורב-מערכתי.
עוד נקודה למחשבה היא שגם טיפולים קונבנציונאליים בסרטן ומחלות אחרות של זקנה מהווים מעיין הסגה לאחור של תהליך ההזדקנות, כיוון שהמחלות האלה הן ביטויים של הזדקנות.
אף אחד מהטיפולים שסקרתי לא ממש מזיז לאחור את המחוג של שעון ההזדקנות. אם יכולנו להזיז את המחוג לאחור אפילו בשניה אחת, יכולנו להזיז אותו גם לנקודת זמן מוקדמת יותר, או לכל הפחות לעצור אותו, על ידי יישום חוזר ונשנה של הטיפול. כל התערבות משפיעה על קומפוננטה מסויימת של ההזדקנות. הטיפול האולטימטיבי יהיה כנראה מורכב מקומבינציה של תכשירים שמשפיעים על קומפוננטות שונות.
מקורות
- Baar, Marjolein P., et al. "Targeted apoptosis of senescent cells restores tissue homeostasis in response to chemotoxicity and aging." Cell 169.1 (2017): 132-147.
- Singh, Bhupendra, et al. "Reversing wrinkled skin and hair loss in mice by restoring mitochondrial function." Cell death & disease 9.7 (2018): 1-14.
- Cassidy, Liam D., et al. "Temporal inhibition of autophagy reveals segmental reversal of ageing with increased cancer risk." Nature communications 11.1 (2020): 1-12.
- Alle, Quentin, et al. "Reprogramming: Emerging Strategies to Rejuvenate Aging Cells and Tissues." International Journal of Molecular Sciences 22.8 (2021): 3990.
- Abad, María, et al. "Reprogramming in vivo produces teratomas and iPS cells with totipotency features." Nature 502.7471 (2013): 340-345.
- Ocampo, Alejandro, et al. "In vivo amelioration of age-associated hallmarks by partial reprogramming." Cell 167.7 (2016): 1719-1733.
- Lu, Yuancheng, et al. "Reprogramming to recover youthful epigenetic information and restore vision." Nature 588.7836 (2020): 124-129.
- Gill, Diljeet, et al. "Multi-omic rejuvenation of human cells by maturation phase transient reprogramming." bioRxiv (2021).
- Mahmoudi, Salah, Lucy Xu, and Anne Brunet. "Turning back time with emerging rejuvenation strategies." Nature cell biology 21.1 (2019): 32-43.